2019年12月10日,国家药监局医疗器械唯一标识数据库(NMPA UDID)正式上线,
自2019年12月至2020年6月对试点企业开放数据申报功能。试点进度安排如下:
试点结束后,国家药监局拟分步推行医疗器械唯一标识制度,将部分有源植入类、无源植入类等高风险第三类医疗器械作为第一批医疗器械唯一标识实施品种。对列入第一批实施产品目录的医疗器械,注册人应当按照以下时限要求向唯一标识数据库提交UDI数据:
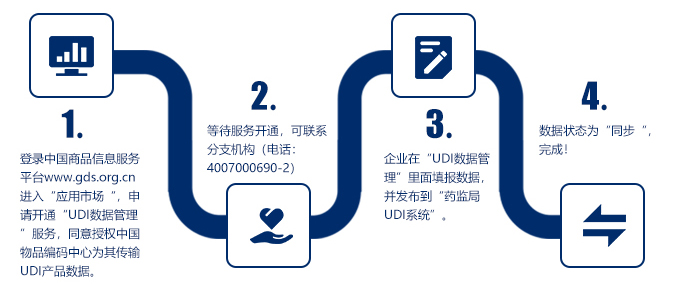
为配合国家药监局医疗器械唯一标识试点及实施工作,中国物品编码中心启动了中国商品信息服务平台与国家药监局UDI数据库的对接工作。GS1系统成员可以通过中国商品信息服务平台中的“UDI数据管理”应用以及全球商品数据共享平台,将 最小销售单元、更高级别包装的产品标识和相关数据向国家药监局UDI数据库进行发布和管理,同时完成DI(GTIN)在中国物品编码中心的备案工作。所有备案的DI(GTIN)信息可以通过“中国编码”APP扫码展示。
此外,作为全球化的GS1 GDSN认证数据池,我们亦可帮助境外GS1系统成员通过GDSN对接UDI数据。
根据国家药监局的相关规定,医疗器械注册人/备案人应当按照相关标准或者规范要求上传、维护和更新唯一标识数据库中的相关数据,并对数据真实性、准确性、完整性负责。中国物品编码中心特此提供“国家药监局UDID数据同步实施指南”(点击链接查看详情),以帮助境内外系统成员顺利参与中国UDI数据库对接工作。
用户通过菜单“产品发布——>发布列表“查看数据状态,当状态为“同步”即可在药监局UDI系统查看数据,第二日可在中国商品信息服务平台“产品管理”里查看到通报的GTIN数据。